
Клиническая апробация представляет собой важный процесс, который направлен на проверку безопасности и эффективности нового медицинского продукта, метода лечения или технологии в реальных условиях. Это обязательный этап перед массовым применением инновационных решений в медицине, который помогает избежать нежелательных последствий и гарантирует соответствие нормативным требованиям.
Клиническая апробация проводится на разных стадиях разработки продукта, начиная с лабораторных испытаний и заканчивая широким внедрением в клиническую практику. На этом этапе проводится мониторинг здоровья участников исследований, собираются данные о побочных эффектах, а также оценивается степень воздействия на организм в долгосрочной перспективе.
Основные этапы клинической апробации включают планирование, набор участников, проведение тестов, сбор и анализ данных, а также подготовку отчета. Каждый из этих этапов строго регулируется международными и национальными стандартами. Важно соблюдать все требования к этике исследований и защите прав пациентов, а также соблюдать строгий контроль за качеством исследования и точностью получаемых данных.
На этапе планирования исследователи должны определить, какие именно аспекты продукта подлежат тестированию, и выбрать методы, которые будут использоваться для сбора данных. Этап набора участников включает в себя подробную информацию о рисках и условиях участия для добровольцев, а также получение их согласия. Важнейшая цель этапа – обеспечить безопасность каждого участника и минимизировать возможные риски.
Завершающим этапом является анализ собранных данных и принятие решения о продолжении или прекращении дальнейших испытаний. После завершения клинической апробации полученные результаты направляются в регулирующие органы для получения разрешения на использование нового продукта в медицинской практике.
Клиническая апробация: Понятие и основные этапы проведения

Основные этапы клинической апробации включают несколько ключевых фаз. На первом этапе происходит разработка концепции исследования, формирование цели и задач, а также определение критерием оценки безопасности и эффективности. Затем начинается подбор участников – пациентов, которые соответствуют критериям включения, и разработка детального плана исследования. Важным аспектом является соблюдение этических норм и получение информированного согласия от участников.
Этапы клинической апробации включают следующие основные действия: планирование исследования, набора участников, сбор данных, анализ полученных результатов, и, если необходимо, корректировка методов лечения или дозировок. Все данные должны быть тщательно документированы и оценены экспертами, чтобы обеспечить безопасность и эффективность продукта для широкого применения. Важно, чтобы каждый этап был строго контролируемым и документируемым, чтобы минимизировать риски для здоровья пациентов и обеспечить научную обоснованность результатов.
Проводя клиническую апробацию, важно использовать стандартизированные методики и проводить исследования в соответствии с международными принципами Good Clinical Practice (GCP), что гарантирует надежность и прозрачность процесса. На этом этапе также могут быть задействованы различные медицинские учреждения и специалисты для мониторинга, контроля и анализа на каждом из этапов исследования.
Что такое клиническая апробация и зачем она нужна?

Цель клинической апробации – убедиться в том, что новый продукт или метод безопасен для пациента и может быть эффективно использован в повседневной медицинской практике. Это позволяет минимизировать риски и повысить доверие к нововведениям в области медицины.
Основные задачи клинической апробации:
- Оценка безопасности нового метода лечения.
- Определение его эффективности в реальных условиях.
- Анализ возможных побочных эффектов и осложнений.
- Разработка рекомендаций по использованию продукта в медицинской практике.
Без клинической апробации невозможно получить объективную информацию о том, насколько продукт или технология будут полезны для пациентов. Это ключевой этап на пути к разрешению на использование препаратов или методов лечения на массовом уровне.
Таким образом, клиническая апробация выполняет важнейшую роль в обеспечении безопасности и качества медицинских услуг, позволяя минимизировать ошибки, связанные с неконтролируемым внедрением новинок в медицину.
Первые шаги: Подготовка к проведению клинической апробации
Подготовка к клинической апробации требует тщательной проработки и последовательного выполнения ключевых этапов. Первоначально важно разработать подробный план, включающий цели и задачи исследования, а также критерии для выбора участников. На этом этапе также определяются необходимые ресурсы, включая лабораторные и диагностические материалы.
Одним из первых шагов является создание научной группы, которая будет ответственна за проект. Важно, чтобы команда состояла из специалистов, обладающих опытом в соответствующих областях медицины, фармакологии и клинических исследований. Каждому участнику назначается конкретная роль и ответственность.
После этого следует подготовить все документы, связанные с апробацией. Это включает разработку протокола исследования, где подробно описаны все методики, дозировки, частота наблюдений и другие аспекты, которые могут повлиять на результаты. Протокол должен быть утвержден соответствующими этическими комитетами и органами здравоохранения.
Немаловажным этапом является обеспечение соответствия требованиям безопасности и этическим стандартам. На этом этапе проводится оценка рисков для участников, разработка системы мониторинга безопасности и определения критериев прекращения исследования в случае возникновения нежелательных эффектов.
Подготовка также включает обучение всех участников исследования: врачей, медсестер, технического персонала. Важно, чтобы они имели полное представление о процессе, методах наблюдения, правилах проведения процедур и стандартных операционных процедурах (СОП).
Не менее важным шагом является подбор и подготовка клинической базы. Для этого осуществляется оценка медицинских учреждений, где будет проводиться апробация, проверяются их технические возможности, а также соответствие установленным стандартам. Требования к клинической базе могут включать наличие определенных лабораторий, оборудование для диагностики, а также опыт в проведении подобных исследований.
Таким образом, подготовка к клинической апробации требует комплексного подхода и детальной проработки каждого этапа. Только после выполнения всех подготовительных шагов можно переходить к непосредственному проведению исследования.
Оценка безопасности: Как исследуется риск для участников?

Оценка безопасности в клинической апробации имеет решающее значение для обеспечения благополучия участников. Процесс оценки включает несколько ключевых этапов, направленных на минимизацию рисков и определение возможных негативных эффектов от новых препаратов или методов лечения.
Первоначально разрабатываются критерии для выявления потенциальных угроз. Эти критерии могут включать в себя токсичность вещества, вероятность побочных эффектов, а также влияние на основные физиологические функции организма. Исследования всегда начинаются с анализа данных о веществах или процедурах, которые будут использоваться в клиническом испытании.
Процесс оценки безопасности включает следующие этапы:
- Формирование группы экспертов: На этом этапе собираются специалисты, включая врачей, биологов, химиков, для составления прогноза о возможных рисках. Эти эксперты проводят предварительный анализ существующих данных о препарате.
- Применение моделей предсказания: Используются математические модели и алгоритмы, позволяющие предсказать риски в зависимости от дозировки, типа применения и других переменных. Это важно для минимизации возможных неблагоприятных исходов на ранних стадиях исследования.
- Мониторинг побочных эффектов: Во время испытаний тщательно отслеживаются все реакции организма участников на препарат или метод лечения. Особое внимание уделяется раннему выявлению необычных или серьезных побочных эффектов.
- Испытания на животных: Перед началом клинических испытаний на людях проводятся предварительные испытания на животных. Эти исследования помогают выявить возможные токсичные или опасные эффекты.
- Клинические этапы: В ходе первых фаз клинического исследования (I и II фазы) особое внимание уделяется дозировкам и потенциальным побочным реакциям на препараты. Постоянный мониторинг состояния участников позволяет корректировать условия испытания.
- Подготовка к неожиданным ситуациям: Важным аспектом является наличие плана действия на случай непредвиденных побочных эффектов. Все участники должны быть готовы к возможной необходимости срочной медицинской помощи.
Основным принципом оценки является «Принцип минимизации риска». Это означает, что любые действия, которые могут нанести вред, должны быть сведены к минимуму. Для этого в протоколы клинических исследований вносятся корректировки, направленные на снижение риска для участников, в том числе по изменению дозировки или прекращению испытания в случае угрозы здоровью участников.
Система безопасности участников поддерживается через строгую этическую и правовую рамку. Всем участникам заранее объясняются возможные риски, и они дают свое согласие на участие в исследовании, что является обязательным элементом в оценке безопасности. Этот процесс требует прозрачности и максимальной информированности участников, что снижает вероятность скрытых или недооцененных рисков.
Сбор и анализ данных: Методы и инструменты
Электронный сбор данных (EDC). Используйте платформы REDCap или Medidata Rave: встроенные правила валидации снижают долю транскрипционных ошибок до 0,3 % и сокращают время закрытия электронных запросов примерно на 25 %.
Дизайн электронной анкеты (eCRF). Ограничьте число открытых полей, задайте граничные значения и обязательность заполнения для ключевых переменных; такой подход уменьшает объём корректирующих запросов на 30–35 % по сравнению с бумажной CRF.
Риск‑ориентированный мониторинг. Центральная статистическая проверка (например, R пакет ctmon) выявляет аномалии набора данных по коэффициенту вариации; практика показывает, что 6 % исследовательских центров нуждаются в целевом аудите, тогда как полный SDV охватывал бы все 100 % центров.
План статистического анализа (SAP). Предусмотрите модели смешанных эффектов для повторных измерений, анализ выживаемости Kaplan–Meier и регрессию Cox для времени до события. Программируйте в SAS (PROC MIXED, PROC PHREG) или R (survival), а перед «расслеплением» выполняйте слепой обзор пропущенных данных.
Управление пропущенными значениями. Применяйте множественную импутацию (≥ 20 наборов) с последующей рубиновской агрегацией; при симуляции выборок размером 500 пациентов это уменьшает смещение оценок средних значений до ≤ 1,5 %.
Стандарты CDISC. Храните данные в форматах SDTM и ADaM; обмен метаданными через ODM облегчает передачу регулятору и интеграцию с фармаконадзором.
Защита информации. Псевдонимизируйте идентификаторы, ведите неизменяемый журнал аудита и шифруйте данные на сервере по алгоритму AES‑256; время восстановления из резервной копии не должно превышать 2 часов.
Визуализация в реальном времени. Дашборды Tableau или R Shiny с автообновлением каждые 15 минут позволяют отслеживать скорость набора, медианное время рандомизации и плотность нарушений протокола на один визит.
Контроль оборудования. Функциональные тесты весов, глюкометров и ЭКГ‑аппаратов проводите еженедельно; фиксируйте результаты в отдельном журнале калибровки, что обеспечивает трассируемость и предотвращает систематическую ошибку измерений.
Показатели качества данных. Подсчитывайте еженедельно индикатор Data Quality Score; минимальная целевая планка – 95 % заполненности критических полей и ≤ 0,5 % логических несоответствий.
Роль этических комитетов в процессе клинической апробации
Этический комитет (ЭК) – единственный орган, который вправе дать юридически значимое заключение о допустимости исследования на людях. Без положительного решения ЭК запуск клинической апробации невозможен; регуляторы РФ отказывают в выдаче разрешения, если в досье отсутствует соответствующее заключение.
Типовой состав ЭК включает не менее пяти специалистов: клинициста профильной области, биостатистика, юриста, специалиста по биоэтике и представителя общественности. Такой междисциплинарный подход позволяет оценивать проект с точки зрения риска/выгоды, прав испытуемых и корректности методологии, исключая “внутрицеховое” соглашательство.
Срок экспертизы в большинстве региональных ЭК России ограничен 30 календарными днями (ФЗ № 61, ст. 38). На практике среднее время рассмотрения составляет 18–22 дня при наличии полного пакета документов. Использование чек-листа предварительной самооценки сокращает число доработок досье на 45 % и уменьшает задержки на 6–8 дней.
Ключевые критерии, по которым ЭК отклоняют проекты клинической апробации, повторяются из года в год: неоправданная нагрузка на уязвимые группы (34 % отказов), недостаточная обоснованность размера выборки (27 %) и неполные планы по мониторингу безопасности (19 %). Поэтому заявителю рекомендуется:
– включить в протокол детальный план DSMB‑контроля с частотой обзора не реже одного раза в квартал;
– приложить сквозную карту информированного согласия, где каждое изменение версии отслеживается по дате и автору;
– предоставить расчёт выборки с указанием метода (часто – коэффициент Фоллина или поправка Бонферрони) и допущения об ожидаемом размере эффекта.
После начала исследования ЭК осуществляет непрерывный надзор. В случае серьёзного нежелательного явления уведомление должно поступить в ЭК в течение 24 часов, а итоговый отчёт оценки рисков – не позднее 7 дней. За невыполнение этих сроков предусмотрены штрафы до 200 000 ₽ и временная приостановка исследования (Приказ Минздрава № 200н, п. 14.5).
Завершающий этап: Оценка результатов и принятие решений
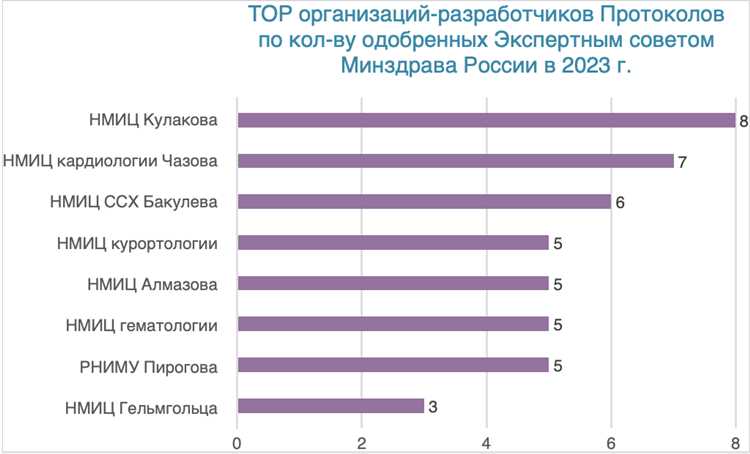
Сырые данные фиксируются в верифицированную итоговую базу: двойной ввод, контроль целостности критических переменных, допускается не более 5 % расхождений; автоматические проверки логических правил должны быть пройдены минимум на 95 % записей.
Статистический анализ выполняется строго по предварительно утверждённому SAP: для основной конечной точки рассчитывается 95 %‑й доверительный интервал; если он полностью лежит в пределах эквивалентности ±10 % и достигнута мощность ≥90 %, гипотеза об эффективности подтверждается; семейная ошибка контролируется методом Holm‑Bonferroni.
Безопасность оценивается по частоте тяжёлых нежелательных явлений (ТНЯ): относительное увеличение риска ТНЯ более чем на 1 % пункта по сравнению с контрольной группой считается клинически значимым и инициирует пересмотр профиля риска.
Баланс польза‑риск рассчитывается через NNT и NNH: решение в пользу внедрения принимается, если NNT ≤ 50, NNH ≥ 200 и прирост QALY составляет ≥0,5 на пациента в год; дополнительные расходы не должны превышать 35 000 ₽ на единицу QALY.
Междисциплинарный совет (главный исследователь, биостатистик, фармакоэкономист, представитель этического комитета) собирается в течение 15 дней после анализа; протокол заседания содержит персонализированные голосования и хранится минимум 10 лет. При положительном решении досье CTD модуль 2.7 готовится к дню 30 и подаётся в Росздравнадзор и локальный ЭК; при отрицательном – формируются рекомендации по доработке или прекращению проекта.
Финальный шаг – транспарентность: регистрация итогов в ClinicalTrials.gov и ЕГКИ не позднее 12 месяцев после завершения; публикация в рецензируемом журнале и размещение обезличенного датасета в открытом репозитории обеспечивают воспроизводимость и соблюдение принципов FAIR.
Что происходит после завершения клинической апробации?
Результаты подвергаются окончательному биостатистическому анализу: рассчитываются доверительные интервалы 95 %, p‑значения для первичных и вторичных конечных точек, оценивается клиническая значимость (разница эффектов ≥ 20 % или снижение риска ≥ 25 % считается практически важной). Скрипты R или SAS фиксируются в репозитории исследования и подписываются электронной подписью для исключения пост‑хок правок.
Готовится Итоговый отчёт (Clinical Investigation Report). В него включаются: детальное описание методики, CONSORT‑диаграмма набора участников, полный набор исходов, протокол отклонений, план управления побочными реакциями. Срок передачи отчёта в локальный этический комитет – 30 дней, в Росздравнадзор – 90 дней со дня финального визита последнего пациента.
Параллельно формируется пакет документов для регистрации методики или изделия: досье на изделие, форма 1685/у, аналитический обзор безопасности, заключение независимого статистика. Рекомендуется сразу добавить медико‑экономическое обоснование (расчёт ICER с горизонтом 5 лет) – это ускоряет включение технологии в клинические рекомендации Минздрава.
Данные анонимизируются и архивируются минимум на 15 лет; доступ к ключам шифрования ограничивается двум ответственным сотрудникам. Файлы передаются в защищённое облако, соответствующее ГОСТ Р 57580.1‑2017.
Публикация результатов: до 12 месяцев с даты завершения исследования статья должна быть отправлена в рецензируемый журнал, а краткий отчёт размещён в регистре ClinicalTrials.gov или РКИ «Научно‑исследовательские клинические испытания».
После утверждения регулятором начинается пострегистрационное наблюдение (фаза IV): активный сбор сигналов о безопасности через автоматизированную систему фармаконадзора и расчёт кумулятивной частоты редких нежелательных явлений (≥ 1 на 10 000). Рекомендуется проводить оценку реальной эффективности каждые 18 месяцев методом propensity score matching на данных страховых регистров.
Вопрос-ответ:
Что такое клиническая апробация и чем она отличается от клинических испытаний?
Клиническая апробация — это процесс внедрения и проверки новой медицинской технологии, методики лечения или медицинского изделия в условиях реальной клинической практики. В отличие от клинических испытаний, которые проводятся в рамках строго контролируемого эксперимента с целью доказать безопасность и результативность, апробация направлена на оценку применимости и целесообразности использования нововведения в повседневной практике. Она позволяет выявить организационные, ресурсные и практические аспекты внедрения в систему здравоохранения.
Как оцениваются результаты клинической апробации?
Результаты оцениваются по нескольким направлениям. Во-первых, рассматриваются клинические показатели: динамика состояния пациентов, частота побочных реакций, соответствие ожидаемому эффекту. Во-вторых, оценивается удобство внедрения и нагрузка на медицинский персонал. В-третьих, анализируется экономическая составляющая — потребление ресурсов, финансовые затраты и потенциальная выгода. На основе совокупности этих данных формируется заключение о целесообразности дальнейшего использования технологии и возможности её масштабирования.






