
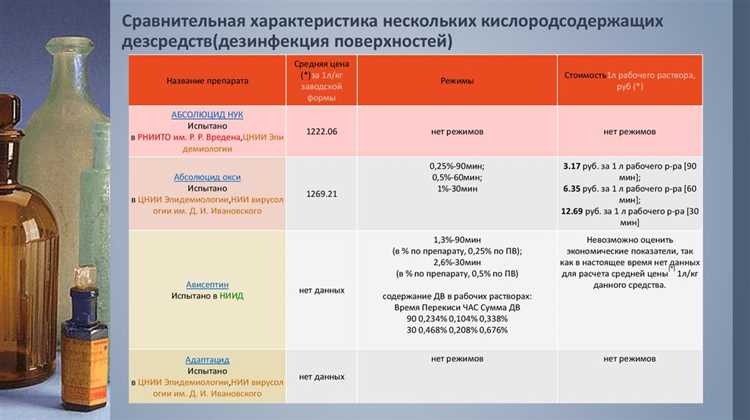
В 2025 году оборот дезинфицирующих средств на территории России регулируется рядом нормативных актов, в первую очередь Техническим регламентом Таможенного союза ТР ТС 019/2011 и постановлением Правительства РФ № 1148. Для легального производства, импорта и реализации дезинфицирующего средства необходимо получить полный комплект документов, подтверждающих безопасность и соответствие продукта установленным требованиям.
Ключевым документом остаётся свидетельство о государственной регистрации (СГР). Оно требуется для всех дезинфицирующих средств, включая кожные антисептики и средства для обработки поверхностей, и выдаётся Роспотребнадзором. При подаче заявки необходимо предоставить протоколы токсикологических, микробиологических и физико-химических испытаний, проведённых в аккредитованных лабораториях. Без актуального СГР продукт не может быть включён в реестр и, соответственно, не допускается к реализации на территории ЕАЭС.
Если средство классифицируется как биоцид, дополнительно требуется досье в формате ОЭСР, содержащее сведения о составе, механизме действия, побочных эффектах и стабильности. Эти требования особенно актуальны в 2025 году в связи с усилением контроля со стороны надзорных органов за биоцидной продукцией, используемой в медицинских, пищевых и образовательных учреждениях.
Важное значение имеет этикетка и инструкция по применению, которые должны быть разработаны в строгом соответствии с ГОСТ 31340-2013. Ошибки в маркировке или отсутствие обязательной информации (например, условий хранения или мер предосторожности) может стать основанием для административной ответственности и изъятия товара из оборота.
Кроме того, производителям и поставщикам следует учитывать обязательность предоставления паспортов безопасности химической продукции по форме, установленной ГОСТ 30333-2007. В 2025 году такие паспорта проверяются при таможенном декларировании и при санитарно-эпидемиологическом контроле.
Нужно ли регистрационное удостоверение для дезинфицирующего средства

В 2025 году наличие регистрационного удостоверения (РУ) обязательно только для дезинфицирующих средств, которые классифицируются как лекарственные препараты. Это касается, в частности, антисептиков, предназначенных для обработки кожи человека в медицинских целях. Такие средства подлежат государственной регистрации в рамках законодательства о лекарственных средствах и вносятся в Государственный реестр лекарственных средств (ГРЛС).
Если дезинфицирующее средство не предназначено для применения на теле человека и используется, например, для обработки поверхностей, оборудования или воздуха, то оно регистрируется как средство биоцидного или санитарно-гигиенического назначения. В этом случае регистрационное удостоверение не требуется, но необходимо пройти государственную регистрацию в Роспотребнадзоре в соответствии с ТР ТС 019/2011 и получить свидетельство о государственной регистрации (СГР).
При отсутствии регистрационного удостоверения у продукта, который должен его иметь по закону, реализация, хранение и транспортировка средства считаются нарушением. Это влечет административную ответственность по статье 6.33 КоАП РФ, а также изъятие продукции с рынка.
Перед выпуском дезинфицирующего средства в обращение рекомендуется провести экспертную правовую оценку назначения и состава продукта, чтобы определить необходимость получения РУ либо СГР. Ошибки в квалификации средства могут привести к значительным штрафам и запрету оборота продукции.
Как оформить технические условия (ТУ) на дезинфицирующее средство

Технические условия (ТУ) на дезинфицирующее средство оформляются в соответствии с требованиями ГОСТ 2.114-2022 и должны включать полное описание продукции, показателей безопасности и методов контроля. Без утверждённых ТУ невозможно начать серийное производство и регистрацию средства.
- Определите область применения: бытовое, медицинское, ветеринарное, промышленное или иное использование.
- Укажите наименование и код продукции по ОКПД 2 и ТН ВЭД при наличии экспорта.
- Опишите состав в процентах или граммах, с обязательным выделением действующих веществ (например, четвертичные аммониевые соединения, спирты, хлорсодержащие компоненты).
- Приведите физико-химические свойства: агрегатное состояние, цвет, запах, рН, плотность, устойчивость к замораживанию и другим условиям хранения.
- Сформулируйте требования безопасности: класс опасности, меры индивидуальной защиты, информация по маркировке и транспортировке согласно ГОСТ 31340-2013 и правилам ADR.
- Определите методы контроля качества: используемые методики (ГОСТ, ТУ, СТО), лабораторное оборудование, показатели стабильности, сроки годности.
- Пропишите правила приёмки и хранения, включая температуру, условия герметичности и допустимые отклонения по составу.
- Укажите требования к маркировке и упаковке с учётом типа тары: канистры, флаконы, аэрозоли и т.п.
Проект ТУ согласовывается с разработчиком, затем проходит утверждение в организации-разработчике. Регистрация ТУ в Росстандарте не требуется, но документ подлежит внутреннему архивированию и может запрашиваться при проверках Роспотребнадзора или Минпромторга.
Для подтверждения корректности ТУ рекомендуется привлекать специализированные испытательные лаборатории и консультантов, имеющих опыт подготовки документации для дезинфицирующих средств в соответствии с санитарным законодательством РФ и ЕАЭС.
Что должно входить в паспорт безопасности химической продукции

Паспорт безопасности химической продукции (ПБ) обязателен для всех дезинфицирующих средств, классифицируемых как опасные вещества или смеси. Документ оформляется в соответствии с ГОСТ 30333-2022 и должен содержать строго регламентированную структуру из 16 разделов.
В разделе 1 указываются идентификаторы вещества или смеси, включая точное торговое и химическое наименование, а также данные изготовителя или поставщика с актуальными контактами.
Раздел 2 описывает потенциальные опасности: класс опасности по ГОСТ 32419-2013, категории риска, маркировку, предупреждающие фразы и пиктограммы.
Раздел 3 содержит полную информацию о составе: перечень ингредиентов с указанием их CAS-номеров, концентраций, а также токсикологических характеристик компонентов, представляющих опасность.
В разделе 4 описываются меры первой помощи при попадании на кожу, в глаза, при вдыхании или проглатывании. Приводятся четкие инструкции для медицинского персонала.
Раздел 5 включает данные о мерах пожаротушения: типы допустимых огнетушащих веществ, особенности тушения, опасные продукты горения.
В разделе 6 перечислены меры по ликвидации аварийных выбросов, включая методы нейтрализации и требования к индивидуальной защите персонала.
Раздел 7 устанавливает правила хранения и обращения с веществом: предельно допустимые условия, материалы тары, совместимость с другими веществами.
Раздел 8 содержит гигиенические нормативы и средства индивидуальной защиты (СИЗ), применяемые при работе с дезинфектантом. Указываются ПДК, методы контроля загрязнений воздуха, требования к вентиляции.
В разделе 9 приводятся физико-химические свойства: агрегатное состояние, цвет, запах, pH, температура вспышки, растворимость в воде, плотность.
Раздел 10 включает сведения о химической стабильности, условиях, при которых возможно опасное разложение, и взаимодействии с другими веществами.
Раздел 11 содержит токсикологические характеристики: LD50, LC50, сведения о раздражающем, сенсибилизирующем, мутагенном и канцерогенном действии.
В разделе 12 оценивается экологическая опасность: токсичность для водных организмов, биоразлагаемость, способность к биоаккумуляции.
Раздел 13 регламентирует порядок утилизации: методы обезвреживания, классификация отходов, рекомендации по транспортировке к местам захоронения.
Раздел 14 описывает требования к транспортировке в соответствии с ДОПОГ, включая номер ООН, класс опасности, упаковочную группу и маркировку.
Раздел 15 содержит информацию о применимых нормативных актах: ссылки на техрегламенты ЕАЭС, федеральные законы и постановления, регулирующие обращение вещества.
В разделе 16 могут быть включены дополнительные сведения: источники данных, ссылки на методики анализа, рекомендации производителя.
Паспорт должен быть составлен на русском языке, с актуальной датой пересмотра и заверен подписью и печатью организации, проводившей разработку документа.
Как получить протокол испытаний для подтверждения свойств дезсредства

Испытания проводятся аккредитованными лабораториями, включёнными в реестр Росаккредитации. Перед направлением образцов необходимо заключить договор с выбранной организацией, указав конкретные показатели, которые должны быть подтверждены: бактерицидная, фунгицидная, вирусоцидная, туберкулоцидная активность и другие свойства в зависимости от заявленного спектра действия.
Количество образцов, сроки испытаний и методики зависят от типа дезсредства и нормативной документации, по которой проводится оценка (ГОСТ, ТУ, СТО). Например, для средств на основе ЧАС или альдегидов требуется проведение санитарно-химических, токсикологических и микробиологических исследований. Испытания на вирусоцидность проходят по методикам, согласованным с Роспотребнадзором или ФБУН.
Важно: испытания проводятся только на полностью оформленном продукте – с маркировкой, инструкцией по применению и точным составом. Изменения рецептуры после проведения испытаний делают результаты недействительными.
Совет: заранее уточняйте перечень необходимых испытаний и сроки, особенно при работе с новыми или комбинированными составами. Это позволит избежать доработок и задержек при регистрации.
Какие документы предъявляются при ввозе дезинфицирующего средства в Россию
В 2025 году при ввозе дезинфицирующих средств на территорию Российской Федерации требуется предоставить полный пакет документов, подтверждающих безопасность и законность оборота продукции. Невыполнение этих требований приводит к задержке или отказу в выпуске товара на таможне.
Обязательные документы при ввозе дезсредства:
- Контракт и инвойс – договор с зарубежным поставщиком и товаросопроводительные документы с указанием наименования, объема и стоимости продукции.
- Транспортные документы – накладные (CMR, коносамент и др.), подтверждающие факт перемещения груза.
- Регистрационное удостоверение (Росздравнадзор) – для продукции, подпадающей под государственную регистрацию как средство медицинского назначения.
- Свидетельство о государственной регистрации (СГР) – для дезсредств, отнесенных к категории товаров, подлежащих санитарно-эпидемиологическому контролю.
- Декларация о соответствии (ТР ТС) – оформляется на продукцию, подлежащую подтверждению соответствия требованиям технических регламентов Таможенного союза.
- Паспорт безопасности химической продукции – обязателен при ввозе опасных химических веществ и смесей, в том числе дезинфицирующих средств.
- Этикетка и инструкция на русском языке – обязательное требование с указанием состава, способа применения и мер предосторожности.
Для корректного оформления документов рекомендуется до начала ввоза:
- Проверить классификационный код ТН ВЭД ЕАЭС для точного определения необходимого пакета разрешений.
- Заранее получить декларацию или свидетельство о госрегистрации, в зависимости от типа продукции.
- Согласовать макеты этикеток и инструкции с требованиями технических регламентов.
Кроме того, при пересечении границы необходимо оформить электронную таможенную декларацию и предоставить все перечисленные документы через систему «ЕАИС Таможни». Нарушение требований по маркировке или неполный комплект документации может привести к конфискации груза или штрафам.
Какие сведения указываются на этикетке дезинфицирующего средства

Наименование продукции – точное название дезинфицирующего средства, совпадающее с регистрационным удостоверением или техническими условиями.
Назначение и область применения – конкретные объекты и поверхности, для которых средство предназначено (например, медицинские учреждения, пищевые производства, бытовое использование).
Состав – полный перечень действующих веществ с указанием их концентрации в процентах или граммах на литр, а также вспомогательных компонентов.
Инструкция по применению – дозировка, способ нанесения, время воздействия и условия разведения, если оно требуется.
Меры предосторожности – указания по безопасности, включая использование средств индивидуальной защиты, противопоказания и действия при попадании на кожу или слизистые.
Срок годности – дата или период, в течение которого средство сохраняет заявленные свойства, а также условия хранения (температура, влажность).
Информация о производителе – наименование, юридический адрес, контактные данные, регистрационный номер и данные о сертификации.
Объем или масса – точное количество жидкости или массы продукта в упаковке.
Номер партии и дата производства – для обеспечения отслеживаемости и контроля качества.
Класс опасности и пиктограммы – в соответствии с требованиями ГОСТ и ТР ТС, включая символы опасных свойств и рекомендации по утилизации.
Какой комплект документов проверяется при продаже дезсредства в аптеке или магазине
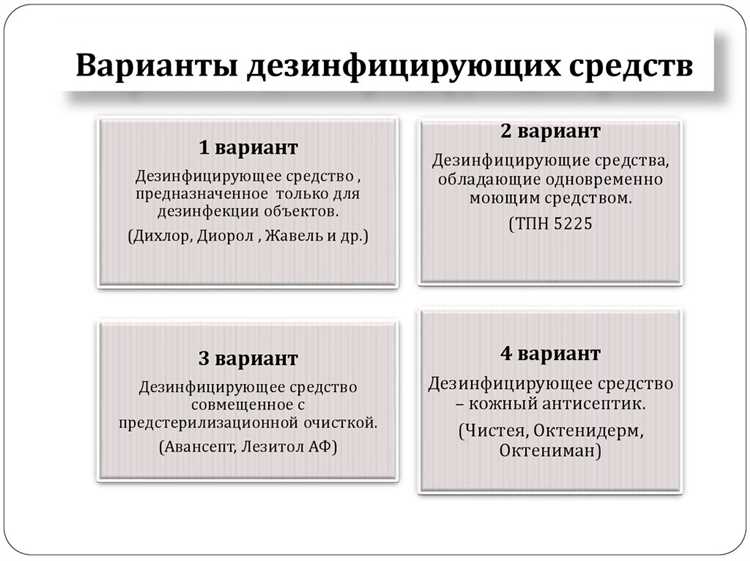
При реализации дезинфицирующих средств в аптечных или торговых точках проверяется обязательный комплект документов, подтверждающий безопасность, качество и соответствие продукции нормативным требованиям.
Основные документы, которые должны быть предоставлены продавцу и доступны для проверки:
| Документ | Назначение | Обязательность |
|---|---|---|
| Регистрационное удостоверение (или свидетельство о регистрации) | Подтверждает разрешение на обращение дезсредства на территории РФ | Обязательно |
| Протоколы испытаний | Документируют результаты лабораторных исследований эффективности и безопасности | Обязательно |
| Паспорт безопасности химической продукции (ПБХП) | Содержит сведения о составе, мерах предосторожности и действиях при аварийных ситуациях | Обязательно |
| Технические условия (ТУ) или Технический регламент | Определяют стандарты производства и характеристики дезсредства | Обязательно |
| Этикетка с необходимой информацией | Обеспечивает информирование покупателя о составе, способе применения, сроке годности | Обязательно |
При продаже в аптеке дополнительно могут требовать инструкцию по применению, если дезсредство имеет специальные условия использования или ограничения. Также следует удостовериться в соответствии упаковки и маркировки требованиям законодательства – отсутствие изменений, актуальность даты производства и сроков годности.
Контрольный осмотр документов включает проверку подлинности регистрационных документов и актуальности протоколов испытаний. В случае сомнений рекомендуется сверять данные с государственными реестрами и обращаться к производителю или поставщику за разъяснениями.
Недопустима продажа дезинфицирующих средств без полного комплекта документов, так как это противоречит требованиям санитарного законодательства и может привести к административной ответственности.
Вопрос-ответ:
Какие документы обязательны для подтверждения безопасности дезинфицирующего средства при его продаже в аптеке?
Для реализации дезинфицирующего средства в аптеке требуется комплект документов, подтверждающих его безопасность и качество. В первую очередь необходим паспорт безопасности химической продукции (ПБХП), где указаны данные о составе, мерах предосторожности и воздействии на организм. Кроме того, обязателен протокол испытаний, подтверждающий антимикробные свойства и эффективность средства. Также необходимо иметь технические условия (ТУ) или регистрационное удостоверение, если средство подлежит регистрации. Наличие маркировки с информацией о производителе и сроке годности тоже проверяется при продаже.
Что входит в протокол испытаний для дезинфицирующего средства и как его получить?
Протокол испытаний представляет собой официальный документ, оформленный аккредитованной лабораторией, где отражены результаты тестов, подтверждающих заявленные свойства средства. В нем указываются методы исследований, концентрация активных компонентов, спектр действия против микроорганизмов и соответствие установленным нормативам. Получение протокола возможно после направления образца средства в лабораторию для проведения анализа. Важно, чтобы испытания проводились с применением методик, рекомендованных законодательством и отраслевыми стандартами.
Нужно ли регистрационное удостоверение для продажи дезинфицирующих средств в России в 2025 году?
Регистрационное удостоверение требуется не для всех дезинфицирующих средств. В 2025 году оно обязательно для препаратов с заявленными лечебно-профилактическими свойствами или для тех, что относятся к медицинским изделиям. Средства бытовой дезинфекции, не заявленные как лекарственные препараты, могут реализовываться на основании технических условий и паспорта безопасности без обязательной регистрации. Однако при ввозе и продаже необходимо строго соблюдать требования нормативных актов и обеспечивать полный комплект документации.
Какие данные должны быть указаны на этикетке дезинфицирующего средства согласно нормам 2025 года?
Этикетка дезинфицирующего средства должна содержать конкретную информацию, обеспечивающую прозрачность для потребителя. В обязательном порядке указываются наименование средства, состав с указанием активных веществ и их концентрации, назначение и область применения, способ использования, срок годности, условия хранения, информация о производителе и контактные данные. Также на этикетке должна быть маркировка, соответствующая требованиям технических регламентов, включая знаки безопасности и предупреждения о возможных рисках при неправильном использовании.






