
Приемочный контроль медицинских изделий – обязательная процедура, обеспечивающая безопасность и соответствие продукции установленным требованиям на этапе поступления в организацию. Регламент проведения такого контроля в России закреплён в ГОСТ 31460-2012, который устанавливает основные правила приемки, критерии оценки и порядок оформления результатов.
Согласно требованиям ГОСТ 31460-2012, при поступлении медицинских изделий проверяют комплектность, целостность упаковки, маркировку, наличие регистрационного удостоверения и сопроводительных документов. Особое внимание уделяют проверке соответствия фактических характеристик изделия данным, указанным в регистрационном удостоверении и технической документации производителя.
Организации обязаны фиксировать результаты приемочного контроля в акте установленной формы. В документе указывают наименование изделия, серию, номер партии, дату приемки, сведения о контролируемых параметрах и заключение комиссии. При выявлении несоответствий допускается оформление акта о выявленных нарушениях и принятие решений о возврате или дополнительной проверке продукции.
Руководителям и ответственным специалистам рекомендуется регулярно актуализировать внутренние регламенты на основании изменений в ГОСТах, а также учитывать специфику применения изделий и условия их эксплуатации. Наличие чётко выстроенной системы приемочного контроля снижает риск ввода в обращение изделий, не отвечающих установленным требованиям безопасности и эффективности.
Документ, регулирующий приемочный контроль медицинских изделий
При закупке изделий, включённых в Перечень медицинских изделий, подлежащих контролю, утверждённый Минздравом России, приемка проводится с обязательным оформлением акта установленной формы. Требования к содержанию и оформлению такого документа закреплены в Приказе Минздрава России от 21.03.2017 № 135н. В акт включают данные о поставщике, номере партии, количестве изделий, реквизитах сопроводительных документов и результатах проверки.
Для отдельных категорий медицинских изделий, например, имплантируемых или требующих специальных условий хранения, контроль осуществляется с учетом положений Технического регламента Таможенного союза ТР ТС 032/2013 «О безопасности медицинских изделий». Этот регламент обязывает проверять соответствие изделий требованиям безопасности, а также наличие регистрационного удостоверения на каждую единицу или партию.
В дополнение к федеральным актам, внутренние стандарты и инструкции медицинской организации должны содержать детализированные процедуры приемки, включая перечень проверяемых параметров, порядок отбора проб и правила фиксации выявленных несоответствий. Разработка таких документов рекомендуется на основании ГОСТ Р 58121.1-2018 и действующих приказов Минздрава.
Таким образом, при организации приемочного контроля медицинских изделий необходимо руководствоваться ГОСТ Р 58121.1-2018, ТР ТС 032/2013, профильными приказами Минздрава и внутренними регламентами учреждения. Несоблюдение установленных требований влечет риск административной ответственности и угрозу безопасности пациентов.
Что такое приемочный контроль медицинских изделий и зачем он проводится

Цель приемочного контроля – выявление несоответствий между поставляемыми изделиями и условиями, указанными в договоре, технической документации, регистрационном удостоверении и нормативных актах. Особое внимание уделяется целостности упаковки, маркировке, наличию эксплуатационной документации, срокам годности и регистрационным данным в Государственном реестре медицинских изделий.
На практике процедура включает осмотр внешнего вида, проверку комплектности, изучение сопроводительных документов и выборочный контроль технических характеристик, если это предусмотрено. Результаты фиксируются в акте приемочного контроля, который оформляется в установленной форме. При выявлении брака или расхождений закупка может быть отклонена, а изделия возвращены поставщику.
Проведение приемочного контроля позволяет минимизировать риск использования дефектных или неправомерно ввезённых медицинских изделий. Это снижает вероятность возникновения инцидентов при их применении, а также обеспечивает соответствие закупок санитарным, техническим и юридическим требованиям.
Выполнение этой процедуры обязательно для учреждений здравоохранения, аптечных организаций и иных юридических лиц, работающих с медицинскими изделиями, в том числе при их закупке по государственным контрактам. Основанием для проведения контроля служат положения Федерального закона № 323-ФЗ, нормативные акты Минздрава России и условия договоров поставки.
Нормативные документы, устанавливающие правила приемочного контроля
Приемочный контроль медицинских изделий проводится на основании конкретных нормативных актов, устанавливающих требования к их проверке, оформлению результатов и допуску к применению. Основной документ – Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». В статье 38 этого закона определены обязанности организаций в части обеспечения качества медицинских изделий и их контроля при поступлении.
Ключевую роль играет постановление Правительства РФ от 31.12.2020 № 2468, которое утверждает Правила организации системы контроля качества и безопасности медицинских изделий. Этот нормативный акт содержит требования к порядку приемки, перечню проверяемых параметров и оформлению заключений о соответствии изделий установленным характеристикам.
Кроме того, применяется ГОСТ Р 58121.1–2018 «Медицинские изделия. Общие требования к системам управления качеством», в котором указаны принципы приемочного контроля, включая порядок отбора образцов, методы испытаний и критерии оценки результатов.
В части оформления документации действует приказ Минздрава России от 14.10.2020 № 1144н. Он регламентирует порядок документирования процедур входного контроля, формы актов и протоколов, а также сроки их хранения в организациях.
Рекомендуется также учитывать положения технических регламентов Таможенного союза, например, ТР ТС 032/2013 «О безопасности медицинских изделий», где установлены обязательные требования к качеству и безопасности продукции на этапе приемки.
Практическая работа специалистов должна опираться на полный перечень действующих нормативных документов, актуализированных на дату проведения контроля. Все используемые положения должны быть официально утвержденными и доступными для проверяющих органов.
Федеральный закон №323-ФЗ и его требования к приемочному контролю

Федеральный закон от 21 ноября 2011 года №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» устанавливает базовые положения, регулирующие обращение медицинских изделий, включая вопросы их приемочного контроля. Документ определяет ответственность медицинских организаций и иных юридических лиц за качество поставляемой и используемой продукции медицинского назначения.
Согласно статье 38 Закона №323-ФЗ, медицинские изделия допускаются к применению на территории России только после государственной регистрации. Однако регистрационное удостоверение не освобождает получателя от обязательства проводить приемочный контроль каждой поступающей партии изделий перед их введением в эксплуатацию. Этот контроль обеспечивает соответствие изделий условиям поставки, эксплуатационной документации и установленным требованиям безопасности.
Пункт 5 статьи 38 предусматривает, что медицинская организация обязана обеспечить проверку поступающих медицинских изделий на наличие маркировки, регистрационного удостоверения, эксплуатационной документации на русском языке, а также провести оценку целостности упаковки и внешнего состояния. В случае выявления несоответствий или признаков повреждения изделия подлежат возврату или изъятию из оборота.
Особое внимание в рамках требований Федерального закона уделяется контролю медицинских изделий, применяемых для проведения хирургических вмешательств, диагностических исследований и реанимационных мероприятий. Для этих категорий изделий руководитель медицинской организации должен обеспечить наличие утвержденного порядка приемочного контроля с указанием ответственных лиц, критериев приемки и регламента документирования результатов проверки.
Федеральный закон также обязывает организации документировать итоги приемочного контроля с фиксацией следующих данных: дата поступления, наименование изделия, номер партии, количество, результаты внешнего осмотра, наличие сопроводительной документации, отметки о соответствии или несоответствии. Хранение этих данных осуществляется в течение срока эксплуатации медицинских изделий, но не менее 5 лет.
Для соблюдения требований статьи 38 медицинским организациям рекомендуется разработать внутренний регламент приемочного контроля, в котором должны быть конкретизированы процедуры проверки изделий разных категорий, критерии отказа от приемки и порядок действий при обнаружении несоответствий.
Роль технического регламента Таможенного союза ТР ТС 032/2013
ТР ТС 032/2013 требует, чтобы каждая партия медицинских изделий проходила приемочный контроль на этапе поступления в медицинскую организацию или на склад. Этот контроль проводится в целях подтверждения соответствия изделия сведениям, указанным в документации, и наличия необходимых разрешительных документов.
В числе конкретных требований, влияющих на организацию приемочного контроля:
- Наличие регистрационного удостоверения на медицинское изделие, выданного уполномоченным органом ЕАЭС.
- Проверка маркировки изделия, которая должна содержать данные о назначении, производителе, сроке годности и условиях хранения.
- Соответствие сопровождающей документации требованиям регламента, включая руководство по эксплуатации, паспорт и сертификаты соответствия.
Кроме этого, ТР ТС 032/2013 определяет критерии к процедурам идентификации изделия по регистрационным данным, включая проверку номера регистрационного удостоверения и его срока действия, а также сверку наименования изделия и комплектации.
Особое внимание регламент уделяет медицинским изделиям, представляющим повышенную степень риска. Для таких изделий приемочный контроль проводится с привлечением профильных специалистов и с обязательной регистрацией результатов в установленном порядке.
В рамках приемочного контроля на основании ТР ТС 032/2013 рекомендуется организовать следующие мероприятия:
- Проверку наличия регистрационного удостоверения и декларации о соответствии.
- Осмотр упаковки на наличие маркировки, идентификационных данных и признаков повреждения.
- Сверку комплектации с данными эксплуатационной документации.
- Проверку соответствия фактических параметров изделия заявленным характеристикам, если это возможно без монтажа и использования.
Соблюдение положений ТР ТС 032/2013 при приемке медицинских изделий – обязательное условие их дальнейшего применения в медицинских учреждениях. Нарушение требований регламента влечет административную ответственность и риск приостановки эксплуатации изделия до устранения выявленных несоответствий.
Какие документы оформляются по итогам приемочного контроля
Акт подписывается ответственными лицами, участвующими в контроле, и служит основанием для дальнейшего допуска изделий к эксплуатации или возврата поставщику.
В случае выявления несоответствий оформляется рекламационная претензия, где подробно описываются выявленные дефекты и требования к устранению. Этот документ направляется поставщику для урегулирования вопроса о качестве продукции.
Кроме того, при необходимости составляется протокол испытаний или измерений, подтверждающий технические параметры изделий, проверенные в процессе контроля. Протокол дополняет акт и служит доказательной базой для оценки качества.
Все документы должны содержать ссылки на нормативные акты, стандарты и технические регламенты, регламентирующие требования к медицинским изделиям и процедурам приемочного контроля.
Результаты приемочного контроля фиксируются в журнале учета приемки, что обеспечивает систематизацию данных и позволяет отслеживать качество продукции на постоянной основе.
Ответственность организации за нарушение порядка приемочного контроля

Нарушение установленного порядка приемочного контроля медицинских изделий влечет за собой административную, гражданско-правовую и в отдельных случаях уголовную ответственность.
Административная ответственность предусматривается статьями 14.43 и 14.44 КоАП РФ. За несоблюдение требований по контролю качества изделий организация может быть оштрафована на сумму до 100 000 рублей. В случае повторного нарушения штраф увеличивается и может сопровождаться приостановкой деятельности.
Гражданско-правовая ответственность связана с возмещением убытков, возникших вследствие поставки некачественной продукции. Организация обязана компенсировать ущерб, включая затраты на повторную проверку и устранение дефектов.
Уголовная ответственность наступает при умышленном выпуске опасных для здоровья изделий. Статья 238 УК РФ предусматривает наказание вплоть до лишения свободы на срок до пяти лет.
Для снижения рисков организация должна внедрить строгий регламент приемочного контроля, обеспечить документирование каждого этапа и проводить регулярное обучение персонала. Важно также своевременно обновлять внутренние нормативы в соответствии с изменениями законодательства и техническими регламентами.
Отсутствие контроля или формальный приемочный контроль подрывают безопасность медицинских изделий и могут привести к отзыву партии, наложению штрафов и репутационным потерям.
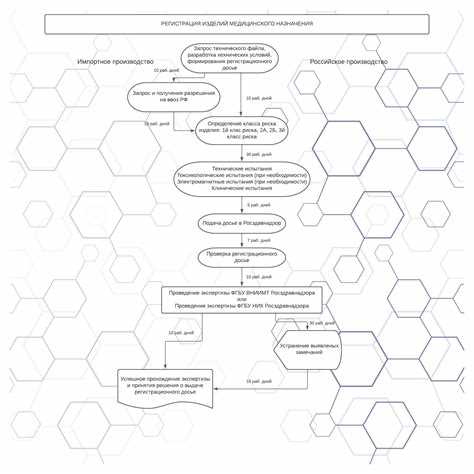
Особенности приемочного контроля импортных медицинских изделий

Приемочный контроль импортных медицинских изделий проводится с учетом требований национального законодательства и международных норм. Основные особенности связаны с необходимостью проверки соответствия продукции установленным стандартам, подтверждения правильности сопроводительной документации и контроля состояния изделий после транспортировки.
- Проверка сопроводительных документов: наличие сертификатов соответствия, регистрационных удостоверений, деклараций о соответствии, инструкций на русском языке.
- Контроль идентификации изделий: сверка маркировки, серийных номеров, штрих-кодов с поставляемой партией и регистрационными документами.
- Оценка целостности упаковки и состояния изделий: выявление механических повреждений, нарушения условий хранения и транспортировки.
- Испытания на соответствие техническим характеристикам и стандартам безопасности, применяемым на территории РФ, включая обязательные процедуры метрологической проверки и калибровки при необходимости.
- Особое внимание к срокам годности и условиям хранения изделий, которые могут отличаться от отечественных аналогов.
- Проверка соответствия нормам Таможенного союза и федеральным требованиям к медицинским изделиям (например, ТР ТС 032/2013).
Рекомендуется разработать регламент приемочного контроля с учетом специфики импорта, включающий обязательные этапы проверки документации и качества изделий. В случае выявления несоответствий допускается возврат партии поставщику или проведение дополнительной экспертизы с участием аккредитованных лабораторий.
Ответственность за проведение контроля и принятие решения о допуске импортных изделий к использованию лежит на уполномоченных сотрудниках организации, оснащенных необходимыми средствами измерений и доступа к нормативной базе.
Порядок хранения документации по приемочному контролю
Документация по приемочному контролю медицинских изделий должна храниться в специально выделенном помещении с контролируемыми условиями: температура 15–25 °C, влажность не выше 60%, отсутствие прямого солнечного света и пыли.
Срок хранения определяется нормативными актами и внутренними регламентами организации, но минимально должен составлять 5 лет с даты проведения контроля.
- Документы должны иметь уникальные идентификаторы и быть систематизированы по дате и типу изделий.
- Хранение допускается как в бумажном, так и в электронном виде при условии обеспечения целостности, защиты от несанкционированного доступа и резервного копирования.
- Ответственные лица назначаются приказом и ведут реестр передачи, перемещения и уничтожения документов.
- Для электронных документов необходимо использование систем с журналированием действий и подтверждением подлинности.
- При передаче документации третьим лицам оформляется акт с указанием состава и условий передачи.
Периодически проводится проверка состояния хранения и полноты документации с фиксированием результатов в журнале аудита.
Вопрос-ответ:
Какие ключевые положения содержит документ, регулирующий приемочный контроль медицинских изделий?
Документ устанавливает порядок проведения приемочного контроля, требования к проверяемой продукции, критерии соответствия, а также регламентирует обязанности ответственных лиц и правила оформления результатов проверки. В нем прописаны методы контроля, виды испытаний и сроки, в которые должна быть завершена проверка. Такой документ служит основой для обеспечения качества и безопасности медицинских изделий при их поступлении в организацию.
Кто отвечает за исполнение требований документа при приемочном контроле медицинских изделий?
Ответственность возлагается на специалистов службы контроля качества или уполномоченных сотрудников, назначенных в организации. Они обязаны проводить проверку изделий в соответствии с регламентом, вести документацию и принимать решение о приемке или возврате продукции. Руководство организации несет ответственность за обеспечение ресурсами и условиями для выполнения этих требований.
Как регулируется хранение документации, связанной с приемочным контролем медицинских изделий?
Правила хранения предусматривают сохранность оригиналов актов и протоколов проверки на протяжении установленного срока, обычно не менее пяти лет. Документы должны храниться в специально отведенных местах, защищенных от повреждений и несанкционированного доступа. Организация обязана обеспечить возможность быстрого поиска и предоставления документов по запросу контролирующих органов.
Какие последствия могут возникнуть при нарушении требований документа, регулирующего приемочный контроль?
Нарушения могут привести к поступлению на склад некачественных или небезопасных изделий, что повлечет риск для пациентов и нарушение законодательных норм. Вследствие этого организация может столкнуться с штрафами, отзывом продукции, приостановкой деятельности или иными санкциями от контролирующих органов. Кроме того, пострадает репутация компании и доверие потребителей.
Можно ли вносить изменения в документ, регулирующий приемочный контроль, и как это оформляется?
Внесение изменений возможно при изменении нормативных требований или внутренних процедур организации. Корректировки оформляются в виде дополнений или редакций документа с обязательным указанием даты и основания изменений. Все изменения должны быть согласованы с ответственными лицами и доведены до сотрудников, участвующих в приемочном контроле. Такой порядок обеспечивает актуальность и соответствие документа текущим требованиям.






